위암
위선암 (gastric adenocarcinoma)의 진단
임상양상
초기엔 대부분 무증상
비특이적 증상: 상복부 불편감, 속쓰림
Alarm sign: 체중감소, 복통, 오심, 소화불량, 조기 포만감, 토혈/흑색변, 철결핍빈혈, 복부종괴
위험요인
식이 요인: 오염된 수질, 소금에 절인 음식, 건조육/훈제고기/가공육
헬리코박터 감염, 만성 위염, 위궤양, 위절제의 과거력
유전성 위암 (CDH1 유전자 변이)
기타: 메네트리에 병, 악성 빈혈, A형 혈액형 등
진단적 검사
선별검사: 만 40세 이상 성인을 대상으로 2년 간격의 위내시경 검사를 권고
(상부위장관 조영술(UGIS)은 민감도가 낮아 참여율이 감소하는 추세)확진: 식도위내시경을 통한 조직생검
궤양이 있을 경우, 궤양의 가장자리(edge)와 기저부(base)에서 다수의 조직을 얻어야 함
병기 설정 검사
: 암의 침범 깊이(T), 림프절 전이(N), 원격 전이(M) 평가
T병기 평가
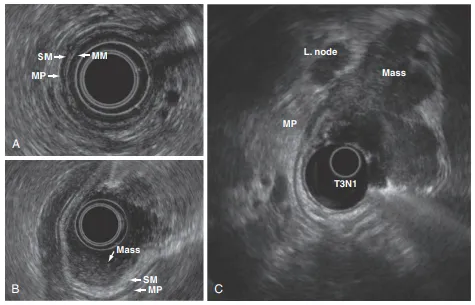
내시경 초음파 : 종양 침범 깊이, 림프절 전이 평가 (T, N stage)에 가장 정확
(특히 조기 위암에서 점막층/점막하층 침범 구분)
(A): 정상 EUS (B): T1N0 gastric cancer (C) T3N1 gastric cancer
N & M 병기 평가
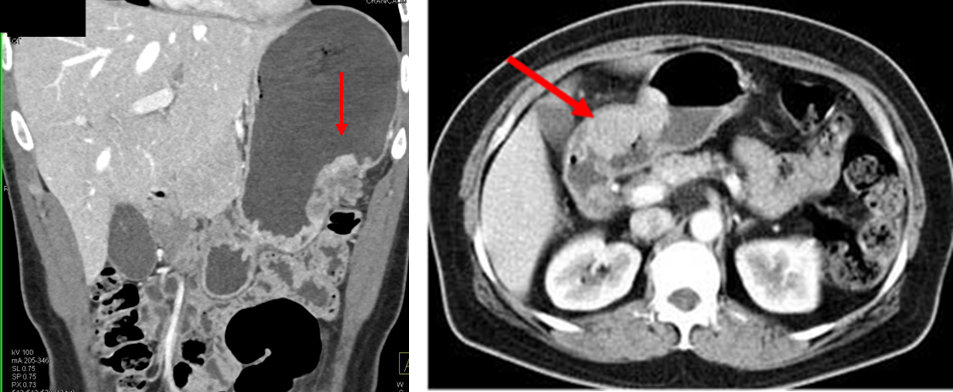
복부골반 CT: 종양 크기 및 위치, 주변 림프절 전이, 인접 장기 침범 진단에 유용
PET CT: 원격 전이 진단, 수술 후 재발이 의심될 경우 유용
진단적 복강경: CT에서 발견되지 않는 작은 복막 전이를 확인하는 데 가장 민감
복강 세척액 세포검사 (Peritoneal washing cytology): 진행성 위암의 병기 결정에 도움이 될 수 있으며, 양성일 경우 원격 전이(pM1)로 분류
조직학적 분류
WHO 분류
관상 선암 (Tubular adenocarcinoma)
유두상 선암 (Papillary adenocarcinoma)
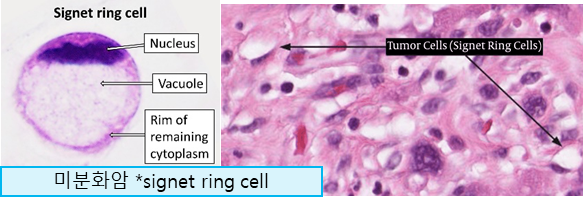
저분화 선암 (Poorly cohesive carcinoma): 반지세포암 (Signet ring cell carcinoma, SRCC) 포함
점액 선암 (Mucinous adenocarcinoma)
Lauren 분류
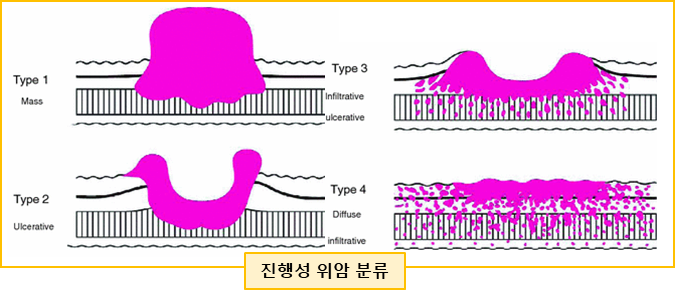
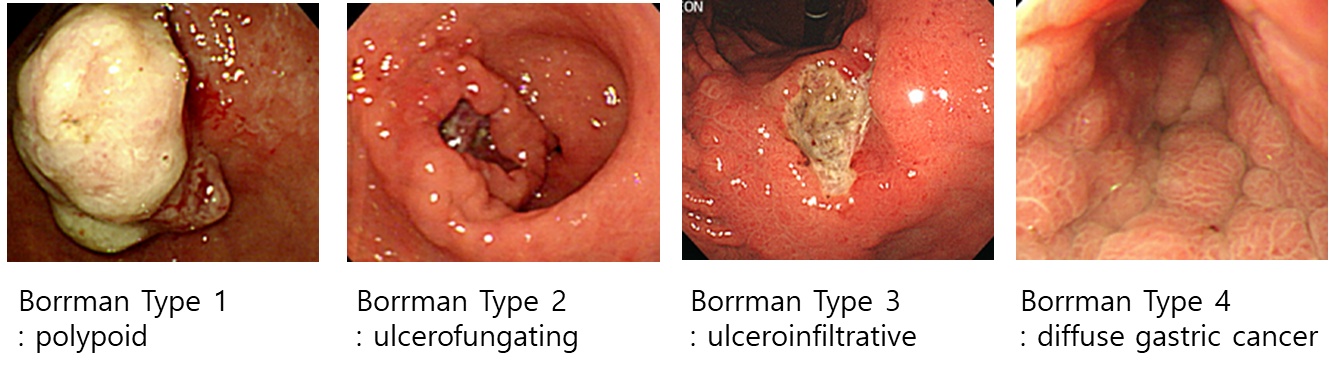
intestinal type gastric cancer: 조직학적으로 선관상의 구조를 유지하고 있고, discrete mass 또는 ulceration으로 나타나는 것이 특징. 대개 고령 환자, 헬리코박터 감염과 연관
diffuse gastric cancer (Borrman type IV): 암세포가 위벽을 따라 미만성으로 침범하여 덩이나 궤양 형태가 아닌 wall thickening (hypertrophic rugae)로 나타나는 것이 특징. 조직학적으로 signet ring cell을 보이며 e-cadherin 단백질 loss를 보임. CDH1 gene mutation과 연관되며, 비교적 젊은 나이에 발병
** 두꺼워진 위 주름 모양을 linitis plastica / leather bottle appearance 소견이라고도 부름
** 2023 KMLE 1교시 54번문항
위암의 병기
병기 (AJCC 8th)
**위주위 림프절 (Regional LN) - Rt & LT paracardial (cardioesophageal)
- perigastric (greater & lesser curvature)
- supra/infrapyloric
- Lt. gastric
- splenic a./splenic hilum
- celiac / common hematic / hepatoduodenal (~proper hepatic)→ 위에 혈액을 공급하는 혈관들 (celiac trunk 와 그 주요 분지 주변 림프절은 regional LN에 해당)
→ pancreas 이하 (pancreatic,SMA,middle colic), 대동맥, 후복막강은 원격 림프절 전이에 해당
복부 해부학 > 혈관 단원 참고원격 전이에 해당하는 병변
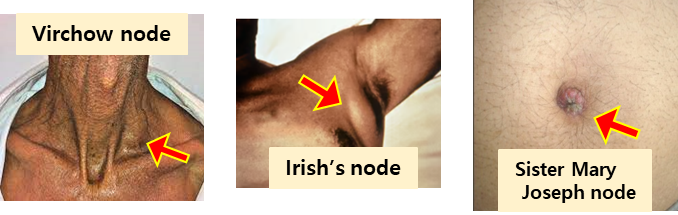
Supraclavicular LN (Virchow’s node)
Irish’s node : Lt. anterior axillary area의 LN촉진
악성 복수 (**2023 KMLE 2교시 46번 문항)
Peritoneal cul-de-sac : Blumer’s rectal shelf
Periumbilical LN : Sister Mary Joseph node
Ovary : Krukenberg’s tumor
수술 불가 LN (M1 lymph node) : 췌장, SMA, 대동맥주위, middle colic, 후복막강
- Peripancreatic, pancreaticoduodenal, retro-pancreatic- Para-aortic, superior mesenteric, middle colic- Retroperitoneal
병기에 따른 위암의 분류
조기 위암 (EGC) : Regional LN 전이와 관계없이 암세포가 점막/점막하층(T1) 국한
진행성 위암 (AGC) : 위암이 근육층 이상 침범시 (T2이상)
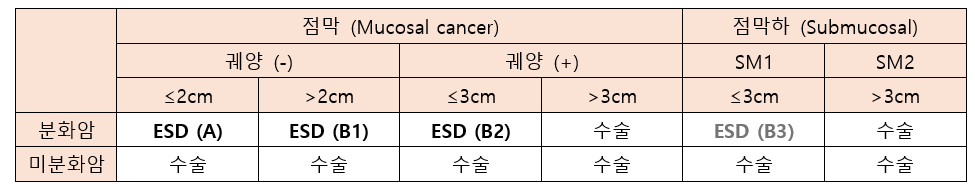
조기 위암 (EGC)
정의: Regional LN 로의 전이와 관계없이 암세포가 점막/점막하층(T1) 국한된 경우
조기 위암의 분류
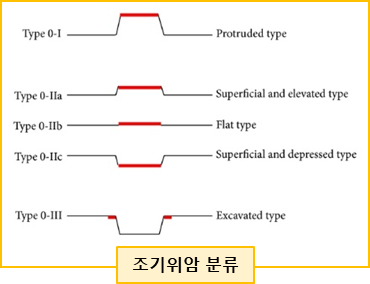
조기위암의 치료
1) T1N0M0 중 ESD/EMR 의 적응증에 해당하면 ESD/EMR을 시행
내시경 절제술의 절대 적응증
점막에 국한된, 분화도가 좋고 궤양이 없는 2cm 이하의 암 (권고등급 A)
내시경 절제술의 확대 적응증
분화형, 점막층 국한, 궤양 없음, 크기 2cm 초과 (권고단계 B1)
분화형, 점막층 국한, 궤양 있음, 크기 3cm 이하 (권고단계 B2)
점막하 침범깊이 SM1 이면서 3cm이하인 분화형 선암 (권고단계 B3) → 2022 한국 가이드라인에서는 수술을 권고
**미분화암: poorly differentiated, poorly cohesive (signet ring cell 위암 포함)
**헬리코박터 파일로리 제균: 내시경 절제술로 성공적으로 치료받은 환자에서 이시성 위암(metachronous gastric cancer) 예방을 위해 제균 치료를 강력히 권고
2) ESD/EMR 후 다음 조건을 모두 만족하지 못하면 추가 위절제술이 필요
병변의 크기와 관계없이 궤양이 없는 점막내 분화형 선암 (A,B1)
궤양이 있더라도 3 cm 이하의 점막내 분화형 선암 (B2)
점막하 침윤 깊이가 500 um (SM1) 이하인 분화형 선암인 경우 (B3)
lymphovascular invasion (-)
vertical margin (-)
→ 미분화형, 점막 침윤 깊이 500um 이상, LVSI (+), vertical margin (+) 중 1개 이상
3) ESD/EMR 적응증에 해당하지 않는 경우 : 위절제술 & 림프절 절제
Distal 2/3에 위암 병변이 있는 경우: distal/subtotal gastrectomy
Proximal 1/3에 있거나 fundus를 보존하지 못하는 경우: total gastrectomy
림프절절제: cT1N0, ≤ 3cm인 경우 D1+ 림프절절제, cT2 or N1 이상인 경우 D2 림프절절제
[1] Harrison’s 22nd edition
[2] Korean Practice Guidelines for Gastric Cancer 2024: An Evidence-based, Multidisciplinary Approach (Update of 2022 Guideline)
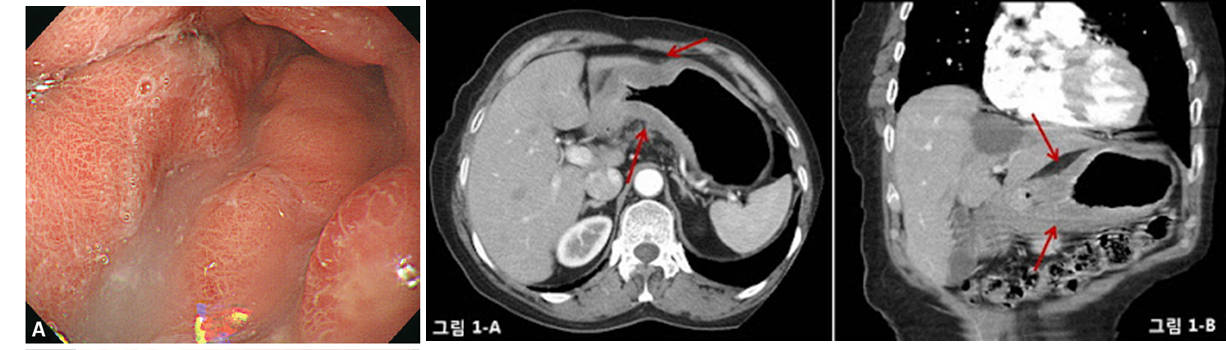
진행성 위암 (AGC)
정의: 위암이 근육층 이상 침범하는 경우 (T2이상)
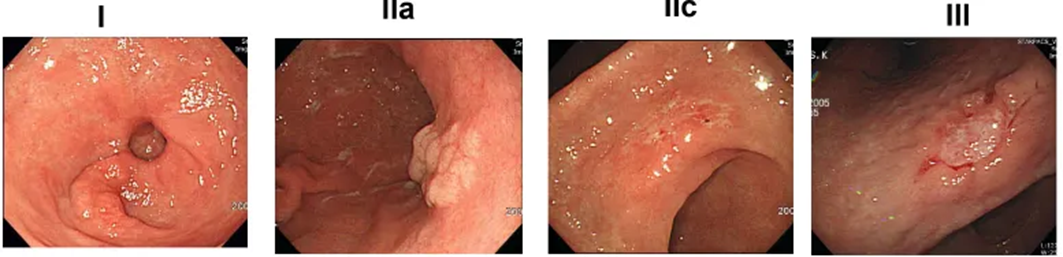
분류 및 내시경 소견
치료
절제가능한 위암 (TnNnM0): 위절제술 + D2 림프절 절제술 → 보조항암치료
Distal 2/3에 위암 병변이 있는 경우: distal/subtotal gastrectomy
Proximal 1/3에 있거나 fundus를 보존하지 못하는 경우: total gastrectomy
절제 불가능한 위암 (TnNnM1): 항암치료 + 고식적 치료
폐쇄에 의한 증상 (구토 등) 완화: 스텐트삽입, 고식적 우회 수술
**둘의 효과는 비슷하나 기대수명이 짧은 경우 stent, 긴 경우 위공장문합술 추천
항암화학요법의 최신 지견 (해리슨 22판, 위암 2024 가이드라인)
» 전이성 위암 환자에서는 치료 시작 전 HER2, PD-L1, MSI, Claudin 18.2 검사를 반드시 시행하여 표적치료 및 면역항암제 사용 가능 여부를 확인
» 전이성 위암 1차 치료: PD-L1 양성인 전이성 위암에서 기존 항암화학요법에 면역관문억제제(Pembrolizumab, Nivolumab)를 병용하는 것이 표준 치료 옵션으로 자리 잡음
» 과거에는 수술 후 보조 항암요법이 주를 이루었으나, 최근에는 수술 전후 항암요법이 국소 진행성 위선암(locally advanced gastric adenocarcinoma)의 치료로 부상
수술 후 보조 항암요법 (Adjuvant)
2기, 3기 환자에게 S-1 단독요법 또는 CAPOX (Capecitabine + Oxaliplatin) 병용요법을 강력히 권고
수술 전 선행 항암요법 (Neoadjuvant)
절제 가능한 국소 진행성 위암 환자에서 수술 전후 항암요법의 일부로 고려할 수 있음
고식적 항암요법 (Palliative)
1차 치료
HER2 음성 & PD-L1 양성 (CPS ≥ 5): 니볼루맙(Nivolumab) + 항암화학요법
HER2 음성 & PD-L1 양성 (CPS ≥ 1): 펨브롤리주맙(Pembrolizumab) + 항암화학요법
HER2 음성 & CLDN18.2 양성: 졸베툭시맙(Zolbetuximab) + CAPOX 또는 FOLFOX
HER2 양성: 트라스투주맙(Trastuzumab) + 항암화학요법
HER2 양성 & PD-L1 양성 (CPS ≥ 1): 펨브롤리주맙(Pembrolizumab) + 트라스투주맙 + 항암화학요법
2차 치료
라무시루맙(Ramucirumab) + 파클리탁셀(Paclitaxel) 병용요법을 강력히 권고
3차 치료
HER2 양성: 트라스투주맙 데룩스테칸(Trastuzumab-deruxtecan)을 우선적으로 강력히 권고
[1] Harrison’s 22e, pg. 645-649
[2] Korean Practice Guidelines for Gastric Cancer 2024: An Evidence-based, Multidisciplinary Approach (Update of 2022 Guideline)
위빈창자연결술 (위공장연결술, Gastrojejunostomy)
위 또는 이자에 암이 있어서 위나 십이지장의 폐쇄가 있는 경우 시행, 고식적치료로 이용됨.
암병변을 제거하지 않고 우회로만 형성하여 장관영양을 가능하게 하는 수술
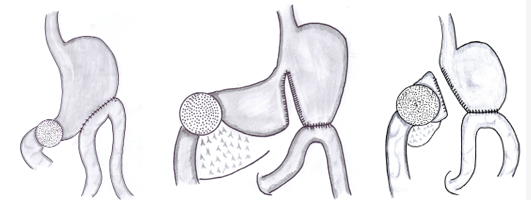
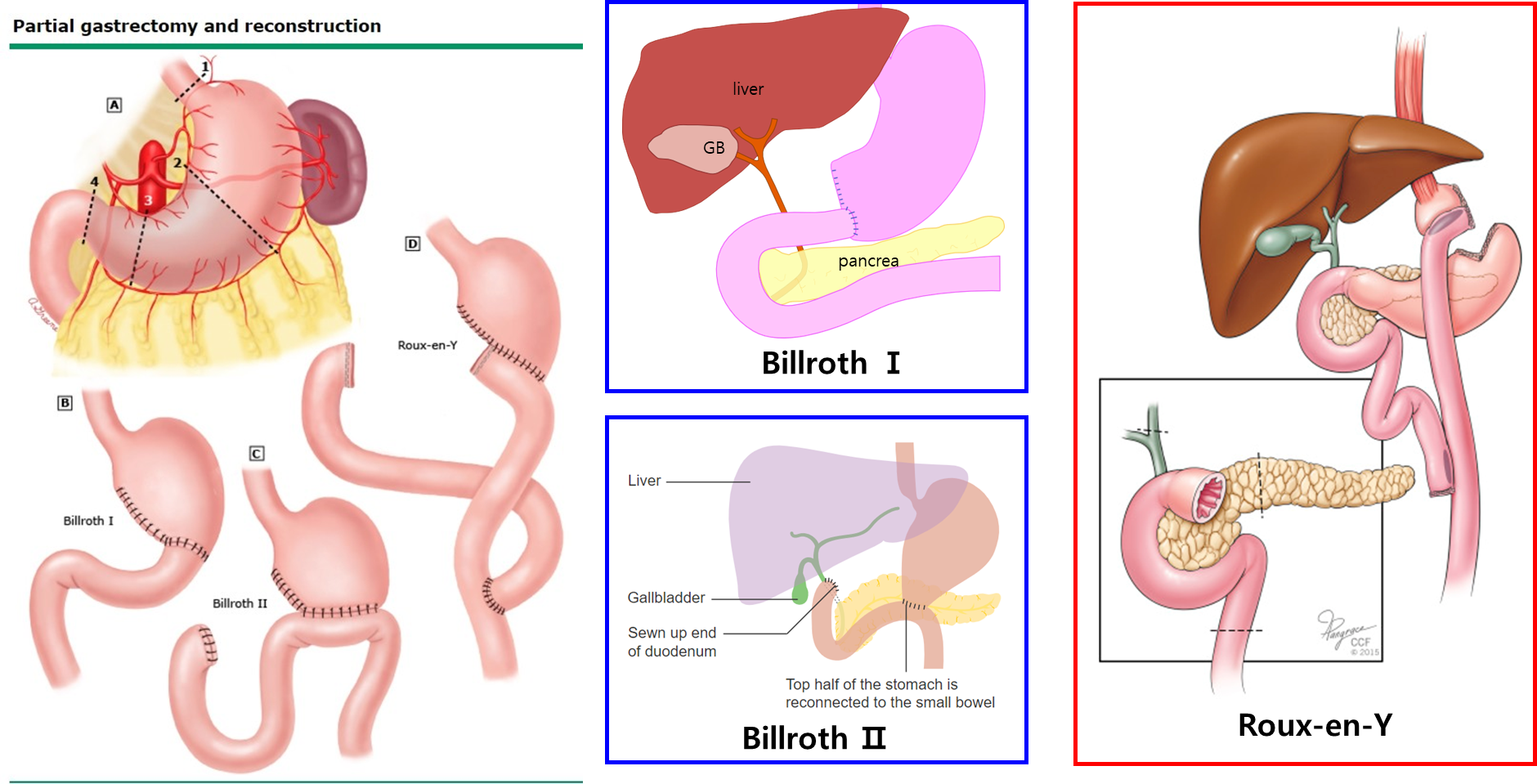
위 수술법
위 부분 절제술 후 남은 장기를 문합하는 방법에는 다음의 방식이 존재한다.
8개의 글
by
호랑호랑이
·
2026년 1월 24일
수술 후 보조 항암요법 (Adjuvant)
2기, 3기 환자에게 S-1 단독요법 또는 CAPOX (Capecitabine + Oxaliplatin) 병용요법을 강력히 권고
여기서 S-1 단독요법이 뭔가요?
by
파도도파
·
2025년 12월 13일
sm1 300um 나오고, 분화도 좋고, LVSI(-)면 추가 위 절제 해야 하나요? 경관 인가요?
궤양없는 3cm 짜리 ESD 하고 분화좋고, LVSI(-), sm1 500um 나온거랑, sm1 400um 나온거는 추후 조치?
by
하쿠나마이
·
2025년 12월 9일
혹시 정확한 내용이라면 추가해서 수정해주실 수 있을까요?
by
눈오리
·
2025년 3월 28일
레지던트 교재와 다른 내용이 있어 여쭙습니다
이 교재에는 조기 위암이더라도 D2가 표준이라고 서술되어있는데 가장 최근 기준으로는 어떤 설명이 맞나요?
교재의 문제 해설 중에서는 mucosa에 국한된 조기위암 중에 1cm이하 병변만 D1을 한다는 내용이 있네요
** 제목만 보더라도 어떤 내용인지 알 수 있도록 완성된 문장으로 작성해주세요.
예시) 초음파 (X) → 초음파 사진에서 PDA 소견을 어떻게 알 수 있나요? (O)